- Auteur Rachel Wainwright [email protected].
- Public 2023-12-15 07:40.
- Laatst gewijzigd 2025-11-02 20:14.
ADASEL
ADASEL: instructies voor gebruik en beoordelingen
- 1. Vorm en samenstelling vrijgeven
- 2. Farmacologische eigenschappen
- 3. Indicaties voor gebruik
- 4. Contra-indicaties
- 5. Wijze van aanbrengen en dosering
- 6. Bijwerkingen
- 7. Overdosering
- 8. Speciale instructies
- 9. Toepassing tijdens dracht en lactatie
- 10. Gebruik bij kinderen
- 11. Gebruik bij ouderen
- 12. Geneesmiddelinteracties
- 13. Analogen
- 14. Voorwaarden voor opslag
- 15. Voorwaarden voor het verstrekken van apotheken
- 16. Beoordelingen
- 17. Prijs in apotheken
Latijnse naam: ADACEL
ATX-code: J07AJ52
Werkzaam bestanddeel: vaccin ter preventie van difterie (met verlaagd antigeengehalte), tetanus en pertussis (acellulair), gecombineerd, geadsorbeerd (tetanustoxoïd, gereduceerd difterietoxoïd en acellulair pertussisvaccin, geadsorbeerd)
Producent: Sanofi Pasteur Limited (Canada)
Beschrijving en foto bijgewerkt: 29-11-2018
Prijzen in apotheken: vanaf 1990 roebel.
Kopen
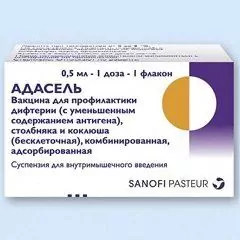
ADASEL [vaccin ter preventie van difterie (met verlaagd antigeengehalte), tetanus en kinkhoest (acellulair), gecombineerd, geadsorbeerd] - MIBP (medisch immunobiologisch geneesmiddel) ter preventie van difterie, tetanus, kinkhoest.
Vorm en samenstelling vrijgeven
Doseringsvorm - suspensie voor intramusculaire toediening: troebele, witachtige, homogene vloeistof (in een kartonnen doos 1 of 5 injectieflacons van 2 ml, die 1 dosis van 0,5 ml vaccin bevatten, en instructies voor het gebruik van ADASEL).
Werkzame stoffen in 1 dosis (0,5 ml):
- geadsorbeerd tetanustoxoïd - 5 Lf * [meer dan 20 IU (internationale eenheden)];
- geadsorbeerd difterietoxoïd - 2 Lf (meer dan 2 IE);
- acellulair kinkhoestvaccin met: geadsorbeerd filamenteus hemagglutinine - 5 μg; geadsorbeerd pertussis-toxoïde - 2,5 μg; geadsorbeerd pertactine - 3 μg; geadsorbeerde agglutinogenen (fimbria) van type 2 en 3 - 5 μg.
Hulpcomponenten: aluminium (in de vorm van aluminiumfosfaat) - 0,000 33 μg; 2-fenoxyethanol - 0,6% (totaal); water voor injectie - tot 0,5 ml.
* Lf - Limes flocculationis (flocculatiedrempel), de hoeveelheid toxoïde die de flocculatiereactie binnengaat met 1 eenheid antitoxine.
Farmacologische eigenschappen
Farmacodynamiek
Tetanus
Het afweermechanisme tegen tetanus is geassocieerd met de productie van neutraliserende antilichamen tegen tetanustoxine. In dit geval moet de laagste beschermende serumconcentratie van tetanus-antitoxische antilichamen, die wordt bepaald met behulp van de neutralisatiemethode, ten minste 0,01 IE / ml zijn.
In klinische onderzoeken met ADASEL werd de beschermende concentratie van tetanus antitoxische antilichamen bepaald op 0,1 IE / ml, en een verhoging van de concentratie van antitoxische antilichamen tot 1,0 IE / ml is geassocieerd met langdurige bescherming. De metingen werden uitgevoerd met behulp van de ELISA-methode (Enzyme Linked Immunoadsorbent Assay) - bepaling met behulp van immunosorbents geassocieerd met enzymen.
Na toediening van het vaccin bereikt de immuunrespons op tetanustoxine een niveau dat eerder als beschermend werd gedefinieerd (≥ 0,1 IE / ml). Dit bevestigt de immunologische werkzaamheid van tetanustoxoïd dat in ADASEL wordt gebruikt.
Difterie
Het afweermechanisme tegen difterie wordt geleverd door antilichamen die het difterietoxine neutraliseren. De laagste serumconcentratie van antitoxische antistoffen tegen difterie die bescherming bieden tegen ziekten is 0,01 IE / ml.
Een anti-difterie-antilichaamconcentratie ≥ 0,1 IE / ml wordt als beschermend beschouwd en ≥ 1,0 IE / ml wordt als langdurige bescherming beschouwd.
Na toediening van ADASEL bereikt de immuunrespons op difterietoxine het niveau dat eerder als beschermend werd gedefinieerd (≥ 0,1 IE / ml). Dit bevestigt de immunologische effectiviteit van het difterietoxoïde dat in het vaccin wordt gebruikt.
Kinkhoest
De werkzaamheid van de kinkhoestantigenen waaruit ADASEL bestaat, werd bevestigd door de concentratie van antilichamen tegen deze antigenen, die werden bereikt met ADASEL met een enkele dosis, te vergelijken met de concentratie van antilichamen tegen dezelfde antigenen, die werden bereikt bij kinderen jonger dan één jaar die drievoudige immunisatie met het vaccin kregen voor kinderen jonger dan 12 maanden. met tetanustoxoïd, AbCDS (een vergelijkbare acellulaire kinkhoestcomponent) en difterietoxoïd (vergelijking werd uitgevoerd in het onderzoek naar de epidemiologische effectiviteit van ADASEL, uitgevoerd in 1992-1995 in Zweden - Zweden I).
De waarde van de indicator van de epidemiologische werkzaamheid van AbCDS is 84,9% tegen bevestigde kinkhoest (een ziekte met aanvallen van krampachtige hoest die ten minste 21 dagen duurt met de vrijlating van de ziekteverwekker Bordetella pertussis of met een vastgesteld epidemiologisch verband met een laboratoriumbevestigd geval van de ziekte). En de epidemiologische effectiviteit van het vaccin in relatie tot kinkhoest, die mild is (minimaal één dag met hoestbuien, met het vrijkomen van Bordetella pertussis) is 77,9%.
De acellulaire pertussiscomponenten die in ADASEL en ABCD zijn opgenomen, verschillen uitsluitend in het aantal CA's (in ADASEL - 2,5 μg, in ABCD - 10 μg). Bij het uitvoeren van klinische onderzoeken naar de humorale respons op kinkhoestantigenen bij volwassenen en kinderen, werd vastgesteld dat hervaccinatie met één dosis ADASEL leidt tot uitgesproken vorming van antilichamen tegen alle kinkhoestantigenen die in het vaccin zijn opgenomen, terwijl het post-vaccinatieniveau van antilichamen 2-5 keer hoger is dan het niveau. bescherming geregistreerd in de Zweden I.
De werkzaamheid van vaccins voor de preventie van tetanus, difterie (laag antigeen) en kinkhoest (acellulair) (AdSbq), waaronder ADASEL, dat wordt gebruikt om kinkhoest te voorkomen, is in verschillende onderzoeken bevestigd. Bij adolescenten die tegen kinkhoest waren geïmmuniseerd met het volledige celvaccin tijdens de zuigelingentijd / vroege kindertijd, lag de effectiviteit van de AdSbq-vaccins tijdens kinkhoestuitbraken tussen de 66 en 75%. Evenzo varieerde de werkzaamheid van AdSbq-vaccins tijdens het uitbreken van kinkhoest tijdens het eerste jaar na vaccinatie bij adolescenten die primaire immunisatie met acellulair kinkhoestvaccin kregen van 73 tot 75%.
Immunogeniteit bij verschillende leeftijdsgroepen van patiënten
De volgende groepen patiënten namen deel aan vergelijkende onderzoeken: kinderen van 4-6 jaar; adolescenten van 11-17 jaar; volwassenen van 18-64 jaar oud.
De concentratie van antilichamen in deze onderzoeken werd één maand (28-35 dagen) na het aanbrengen van ADASEL bepaald.
Het was gevonden:
- tetanus: in 100% van de gevallen van vaccingebruik bij alle patiëntengroepen werd de concentratie van antilichamen tegen tetanustoxoïd op het beschermingsniveau (≥ 0,1 E / ml) bereikt;
- difterie: beschermende concentratie van antilichamen tegen difterietoxoïd (≥ 0,1 E / ml) werd waargenomen bij 94,1% van de volwassenen, 99,8% van de adolescenten en 100% van de kinderen;
- pertussis: bij het beoordelen van het niveau van de immuunrespons op pertussis-antigenen in alle leeftijdsgroepen van patiënten, werd opgemerkt dat hervaccinatie leidt tot een uitgesproken toename van het niveau van antitoxische antilichamen tegen pertussis-toxine, dat het beschermende niveau dat wordt waargenomen in de Zweden I-studie met 2 à 5 keer overschrijdt.
Duur van de beschermende werking ADASEL
Tijdens een langdurige (meer dan 10 jaar) observatie van de persistentie van het niveau van antilichamen tegen vaccinantigenen bij volwassenen en adolescenten die in de vroege kinderjaren werden gevaccineerd tegen tetanus, difterie en kinkhoest (met behulp van een vaccin met een kinkhoestcomponent van hele cellen) en na hervaccinatie ADASEL werd aangetoond dat de beschermende indicatoren voor tetanus- en difterietoxoïden 10 jaar na vaccinatie behouden bleven (respectievelijk in 99,2 en 92,6%).
De concentratie van kinkhoestantistoffen gedurende 5 jaar bleef 2-9 keer hoger dan de initiële waarde, 10 jaar na vaccinatie, dit niveau daalde tot het initiële niveau (vóór vaccinatie). Studies naar de duur van immuniteit na vaccinatie en gegevens over de studie van herhaalde toedieningen van ADASEL bevestigen de mogelijkheid van het gebruik met een interval van 10 jaar in plaats van vaccins die alleen difterie- en tetanustoxoïden bevatten.
Gebruiksaanwijzingen
Het ADASEL-vaccin wordt gebruikt bij personen van 4-64 jaar voor hervaccinatie tegen tetanus, difterie en kinkhoest.
Contra-indicaties
Absoluut:
- kinderen jonger dan 4 jaar, ouderen ouder dan 64 jaar;
- encefalopathie (bijvoorbeeld verminderd bewustzijn, coma, herhaalde convulsies) binnen zeven dagen na toediening van het vaccin, dat de kinkhoestcomponent omvatte, tenzij een andere oorzaak wordt vastgesteld;
- progressieve neurologische ziekte, progressieve encefalopathie of ongecontroleerde epilepsie;
- acute ziekten van infectieuze / niet-infectieuze etiologie, verergering van chronische ziekten (dit zijn tijdelijke contra-indicaties, in dit geval kan vaccinatie worden uitgevoerd na herstel of tijdens remissie). In het geval van acute darmaandoeningen, milde acute respiratoire virale infecties en andere aandoeningen, is vaccinatie mogelijk onmiddellijk na normalisatie van de lichaamstemperatuur;
- belaste geschiedenis van anafylactische reacties op geneesmiddelen die difterie-, tetanustoxoïd en pertussisvaccin bevatten.
Relatief (ADASEL wordt voorgeschreven onder medisch toezicht):
- zwangerschap;
- lactatieperiode.
ADASEL, gebruiksaanwijzing: methode en dosering
Het ADASEL-vaccin wordt intramusculair in de deltaspier van de schouder geïnjecteerd. U kunt het vaccin niet intra- of subcutaan injecteren, in de gluteusspier en het vaatbed.
De dosis ADASEL voor hervaccinatie is 0,5 ml eenmaal.
Op basis van nationale richtlijnen kan ADASEL, indien nodig, worden gebruikt bij volwassenen en oudere kinderen in plaats van het difterie- en tetanusvaccin voor herhalingsvaccinaties tegen difterie, pertussis en tetanus.
In de behandelkamer, waar immunisatie wordt uitgevoerd, moet antishocktherapie worden toegepast (epinefrinehydrochloride-oplossing voor injectie 1 ÷ 1000, glucocorticosteroïden en andere geschikte geneesmiddelen). De aanbevolen observatieduur van de toestand van de patiënt na toediening van het geneesmiddel is ten minste 30 minuten.
Voordat ADASEL wordt geïntroduceerd, moet de inhoud van de injectieflacon worden beoordeeld op verkleuring en / of de aanwezigheid van vreemde insluitsels. Als er afwijkingen worden gevonden, kan het vaccin niet worden toegediend.
Voor toediening de fles schudden tot een troebele homogene suspensie is verkregen.
De kurk van de injectieflacon moet worden gedesinfecteerd met een antisepticum voordat de vaccindosis wordt ingenomen.
De stop en de metalen dop die deze vasthoudt, mogen niet van de fles worden verwijderd.
De introductie van het vaccin moet worden uitgevoerd in overeenstemming met de regels voor asepsis.
Bijwerkingen
Pijn op de injectieplaats is volgens de resultaten van klinische onderzoeken met ADASEL bij personen van 4-64 jaar de meest voorkomende lokale reactie die wordt veroorzaakt door het injecteren van het geneesmiddel.
In de meeste gevallen werd de ontwikkeling van lokale reacties geassocieerd met de introductie van de suspensie opgemerkt binnen drie dagen vanaf het moment van vaccinatie, hun gemiddelde duur is minder dan 3 dagen.
Erytheem / oedeem op de injectieplaats van ≥ 35 mm 3 dagen na vaccinatie werd (respectievelijk) opgemerkt:
- kinderen: 11,7 / 10,1%
- adolescenten: 5,9 / 6,2%
- volwassenen: 4,8 / 5,2%
De meest voorkomende algemene reacties: bij kinderen - verhoogde vermoeidheid, bij adolescenten en volwassenen - hoofdpijn. Een stijging van de lichaamstemperatuur> 38 ° C werd in minder dan 10% van de gevallen opgemerkt. Deze stoornissen waren van korte duur en werden gekenmerkt door een milde of matige intensiteit. Een verhoging van de lichaamstemperatuur> 39,5 ° C drie dagen na vaccinatie werd waargenomen bij kinderen en adolescenten (in 0,3 en 0,1% van de gevallen) en werd niet waargenomen bij volwassenen.
Mogelijke bijwerkingen (> 10% - zeer vaak;> 1% en 0,1% en 0,01% en <0,1% - zelden; <0,01% - zeer zelden):
- systemische reacties (1 - kinderen, 2 - adolescenten, 3 - volwassenen): zeer vaak - zwelling van de gewrichten 2,3, hoofdpijn, misselijkheid 2, anorexia 1, diarree, spierpijn 2,3, spierpijn of spierzwakte 2, 3, algemene malaise, koude rillingen 2; vaak - misselijkheid 1, koorts, braken, spierpijn 1, vergrote oksellymfeklieren, huiduitslag, spierpijn of spierzwakte 1, koude rillingen 1,3, zwelling in de gewrichten 1;
- lokale reacties op de injectieplaats: zeer vaak - zwelling, pijn, roodheid.
Informatie over de volgende bijwerkingen werd spontaan gemeld tijdens de postmarketingperiode van ADASEL-gebruik, terwijl het onmogelijk is om hun oorzakelijk verband met het gebruik van het vaccin en de frequentie van voorkomen vast te stellen.
Mogelijke overtredingen die zijn geregistreerd tijdens het gebruik van het vaccin na registratie:
- zenuwstelsel: flauwvallen, hypesthesie, Guillain-Barré-syndroom, paresthesie, neuritis brachiale zenuw, aangezichtsverlamming, convulsies, myelitis;
- immuunsysteem: overgevoeligheidsreactie (anafylactisch) - uitslag, oedeem, angio-oedeem, hypotensie;
- cardiovasculair systeem: myocarditis;
- bewegingsapparaat: spierkrampen, myositis;
- huid en onderhuids weefsel: huiduitslag, jeuk;
- reacties op de injectieplaats van het vaccin en algemene reacties: aseptisch abces, hematoom op de injectieplaats, wijdverspreide reacties op de injectieplaats (meer dan 50 mm), uitgebreide zwelling van het ledemaat dat zich vanaf de ADASEL-injectieplaats verspreidt over een / twee gewrichten.
Overdosering
Niet toepasbaar.
speciale instructies
ADASEL kan, net als elk ander vaccin, niet 100% bescherming bieden voor alle gevaccineerde personen.
Aangezien elke intramusculaire injectie een hematoom kan veroorzaken op de injectieplaats, in aanwezigheid van bloedstollingsstoornissen, bijvoorbeeld bij hemofilie of trombocytopenie, en ook bij patiënten die anticoagulantia gebruiken, mag ADASEL niet worden gevaccineerd, tenzij de voordelen opwegen tegen de risico's. Als een beslissing wordt genomen over intramusculaire toediening van een vaccin aan een bepaalde groep personen, moet het medicijn met uiterste voorzichtigheid worden gebruikt, in overeenstemming met maatregelen die zijn gericht op het voorkomen van de vorming van hematoom na injectie.
De ontwikkeling van overgevoeligheidsreacties op een van de componenten van het vaccin is mogelijk na toediening van ADASEL, zelfs bij personen zonder voorgeschiedenis van overgevoeligheidsreacties op de componenten van het geneesmiddel.
Tegen de achtergrond van verminderde immuniteit (bijvoorbeeld door immunosuppressieve therapie), is het mogelijk dat de immuunrespons na vaccinatie niet wordt gevormd. Om deze reden mag vaccinatie, indien mogelijk, pas worden uitgevoerd nadat het gebruik van immunosuppressiva is beëindigd. Deze aanbeveling is niet van toepassing op patiënten met chronische immunodeficiëntie, in het bijzonder degenen met een hiv-infectie.
Voor progressieve / onstabiele neurologische aandoeningen, ongecontroleerde epilepsie of progressieve encefalopathie wordt pas vaccinatie gegeven als aan 3 voorwaarden is voldaan:
- Het behandelingsregime voor deze ziekten is bepaald.
- Staatsstabilisatie is bereikt.
- De voordelen van ADASEL-toediening wegen duidelijk op tegen de risico's.
In gevallen waarin het Guillain-Barré-syndroom zich ontwikkelt binnen 6 weken na toediening van een vaccin dat tetanustoxoïd bevat, moet de beslissing om ADASEL of een ander vaccin dat tetanustoxoïd bevat te gebruiken op basis van een zorgvuldige beoordeling van de verhouding tussen het verwachte voordeel en het mogelijke risico.
Invloed op het vermogen om voertuigen te besturen en complexe mechanismen
Het effect van ADASEL op het vermogen om voertuigen te besturen is niet onderzocht.
Toepassing tijdens dracht en lactatie
ADASEL tijdens zwangerschap / borstvoeding kan alleen worden gebruikt als het verwachte voordeel opweegt tegen het mogelijke risico.
De reproductietoxiciteit van het medicijn, evenals het effect ervan op de ontwikkeling van het embryo en de foetus, is niet onderzocht.
Vaccinatie tijdens de zwangerschap wordt niet aanbevolen, tenzij er een duidelijk risico op kinkhoest bestaat. Het vaccin is geïnactiveerd, dus het risico voor het embryo / de foetus is onwaarschijnlijk. De arts moet de balans tussen de voordelen en het risico van het gebruik van ADASEL op individuele basis zorgvuldig afwegen in het geval van een uitbraak van infectie in de gemeenschap of in de aanwezigheid van een grote kans op infectie door een ziek familielid.
Het effect van het medicijn tijdens borstvoeding is niet onderzocht. Het vaccin is geïnactiveerd, dus het risico op nadelige effecten voor moeder en baby is onwaarschijnlijk. De vraag naar de mogelijkheid / noodzaak om ADASEL toe te dienen, wordt echter alleen individueel door de arts beslist.
Gebruik in de kindertijd
Voor patiënten jonger dan 4 jaar is ADASEL gecontra-indiceerd.
Gebruik bij ouderen
Deze hervaccinatie is gecontra-indiceerd voor personen ouder dan 64 jaar.
Geneesmiddelinteracties
Gelijktijdig gebruik van ADASEL met trivalent geïnactiveerd griepvaccin en hepatitis B-vaccin is mogelijk.
De resultaten in termen van immunogeniciteit en veiligheid bij volwassenen zijn vergelijkbaar met zowel de gelijktijdige toediening van ADASEL en het driewaardige geïnactiveerde influenzavaccin, als wanneer deze vaccins een maand na elkaar worden gegeven.
Bij adolescenten werden de immunogeniteit en veiligheid van ADASEL en het vaccin ter preventie van hepatitis B, gelijktijdig toegediend en met een interval van 1 maand, vergeleken. In beide gevallen werd tijdens de vorming van de immuunrespons geen wederzijdse invloed op een van de antigenen waargenomen.
Bij gelijktijdig gebruik van ADASEL met andere vaccins, moet elk vaccin met verschillende spuiten in verschillende delen van het lichaam worden geïnjecteerd, bij voorkeur in verschillende ledematen.
De vorming van een immuunrespons kan worden beïnvloed door immunosuppressiva die gelijktijdig met ADASEL worden gebruikt. Immunosuppressieve therapie, waaronder bestralingstherapie, het gebruik van alkylerende geneesmiddelen, antimetabolieten, cytotoxische geneesmiddelen en glucocorticosteroïden (in doses die de therapeutische waarde overschrijden), kan leiden tot een afname van de immuunrespons op het vaccin.
Het is verboden ADASEL in één spuit te mengen met preparaten die bedoeld zijn voor parenterale toediening.
Analogen
ADASEL-analogen zijn geadsorbeerd pertussis-difterie-tetanusvaccin (DTP-vaccin), Infanrix [vaccin ter preventie van difterie, tetanus, pertussis (acellulair) drie-componenten geadsorbeerde vloeistof].
Voorwaarden voor opslag
Bewaren bij 2-8 ° C, niet invriezen. Ingevroren suspensie mag niet worden gebruikt. Buiten bereik van kinderen bewaren.
De houdbaarheid is 3 jaar.
Voorwaarden voor uitgifte van apotheken
Op recept verkrijgbaar.
Recensies over ADASEL
Er zijn maar weinig beoordelingen van ADASEL, aangezien het medicijn onlangs is geregistreerd. De meeste reacties houden verband met de verwachting van het vaccin op de markt, aangezien het niet alleen kinkhoestprofylaxe mogelijk maakt bij kinderen vanaf 4 jaar, maar ook bij volwassen patiënten.
Prijs voor ADASEL in apotheken
De geschatte prijs voor ADASEL (1 fles) is 2050-2602 roebel.
ADASEL: prijzen in online apotheken
|
Medicijnnaam Prijs Apotheek |
|
Adacel Vaccin ter preventie van difterie 0,5 ml / dosis suspensie voor intramusculaire toediening van 0,5 ml 1 st. 1990 RUB Kopen |

Anna Kozlova Medisch journalist Over de auteur
Opleiding: Rostov State Medical University, specialiteit "General Medicine".
Informatie over het medicijn is gegeneraliseerd, wordt alleen ter informatie verstrekt en vervangt de officiële instructies niet. Zelfmedicatie is gevaarlijk voor de gezondheid!